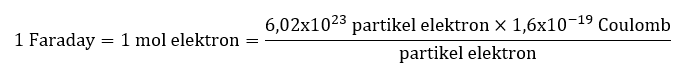Jika Anda seorang ahli kimia atau ilmu pengetahuan yang tertarik pada elektrokimia, Anda pasti telah mendengar tentang satuan faraday. Satuan ini ditemukan oleh seorang ilmuwan bernama Michael Faraday pada awal abad ke-19.
Pengertian Satuan Faraday
Satuan faraday digunakan untuk mengukur jumlah muatan listrik yang diperlukan untuk mendepositkan atau membentuk satu mol dari suatu unsur selama proses elektrolisis. Secara resmi, satuan faraday didefinisikan sebagai jumlah muatan listrik yang dilewatkan melalui elektrolit selama elektrolisis satu mol zat tersebut.
Satuan faraday juga digunakan dalam bentuk satuan yang lebih kecil, yaitu coulomb. Satu faraday setara dengan 96.485 coulomb. Ada berbagai aplikasi dari satuan faraday, termasuk dalam produksi logam dan dalam reaksi elektrokimia seperti sel elektrokimia.
Konversi Satuan Faraday
Konversi dari satuan faraday ke satuan coulomb atau sebaliknya dapat dilakukan dengan mudah dengan mean menggunakan rumus konversi berikut:
- 1 faraday = 96,485 coulomb
- 1 coulomb = 0.00001035 faraday
Semua ini adalah dasar yang penting dalam memahami satuan faraday dan bagaimana itu digunakan dalam kimia dan ilmu pengetahuan.
FAQ
Apa arti satuan Faraday?
Satuan faraday didefinisikan sebagai jumlah muatan listrik yang dilewatkan melalui elektrolit selama elektrolisis satu mol zat tersebut.
Siapa yang menemukan satuan Faraday?
Satuan faraday ditemukan oleh seorang ilmuwan bernama Michael Faraday pada awal abad ke-19.
Apa aplikasi dari satuan Faraday?
Ada berbagai aplikasi dari satuan faraday, termasuk dalam produksi logam dan dalam reaksi elektrokimia seperti sel elektrokimia.
Kesimpulan
Satuan faraday adalah satuan penting dalam kimia dan ilmu pengetahuan yang digunakan untuk mengukur jumlah muatan listrik yang dilewatkan melalui elektrolit selama elektrolisis satu mol zat tersebut. Memahami satuan faraday dan konversinya ke satuan lainnya seperti coulomb sangat penting bagi para ahli kimia dan ilmuwan dalam aplikasi mereka dalam produksi logam dan reaksi elektrokimia.